



CogentMarketing
6774 x 4440




CogentMarketing
8504 x 7559
Giovanni_Cancemi
3000 x 3000
Giovanni_Cancemi
3000 x 3000

CogentMarketing
5779 x 6890


Giovanni_Cancemi
3000 x 3000



Giovanni_Cancemi
3000 x 3000








Giovanni_Cancemi
3000 x 3000

Giovanni_Cancemi
3000 x 3000







ru.depositphotos.com
Дмитрий Зоров,доктор биологических наук, МГУ им. М. В. Ломоносова«Коммерсантъ Наука» №5, июль 2017
Внутреннюю организацию клетки животных и растений можно сравнить с коммуной, где все равны и каждый выполняет одну, очень специфическую роль, создавая сбалансированный ансамбль. И вот только одна структура, митохондрия, может похвастаться множественностью внутриклеточных функций, которые определяют ее уникальность и обособленность, граничащие с некоторой самодостаточностью.
Эту структуру открыли в середине XIX века, и в течение 150 лет почти все считали, что ее единственная функция — быть энергетической машиной клетки. Грубо говоря, организм получает питательные вещества, которые после определенной деградации доходят до митохондрии и дальше происходит окислительная деградация питательных веществ, сопряженная с запасанием энергии в виде богатой энергией фосфорной связи в молекуле АТФ. Организм повсеместно использует энергию АТФ, расходуя ее на проведение нервного сигнала, мышечное сокращение, образование тепла, синтез нужных клеточных компонентов, уничтожение ненужных веществ и пр. В сутки в организме человека генерируется АТФ, весом равная весу самого человека, и в основном это заслуга митохондрий. До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует.
До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует
Постулат доминирующей в клетке энергетической функции митохондрии как-то оставлял в тени уже давно высказанную и всеми поддерживаемую теорию бактериального происхождения митохондрий. В простой трактовке она выглядит так: около 600 млн лет назад в клетку т. н. гетеротрофов внедряется бактерия, которая умеет утилизировать кислород. Есть точка зрения, что появление внутри клетки нового типа бактерий было вызвано постоянным увеличением в атмосфере Земли кислорода, начавшим поступать из мирового океана в атмосферу около 2,4 млрд лет назад. Высокая окислительная способность кислорода представляла опасность для внутриклеточных органических и неорганических элементов, и появляются бактерии, уничтожающие кислород в присутствии ионов водорода с образованием воды. Таким образом внутри клетки содержание кислорода уменьшается, а с ним и уменьшается вероятность нежелательного окисления клеточных компонентов, что, наверно, полезно для клетки.
Однако попадание в ядерную клетку бактерий давало им и ряд преимуществ, в частности, оно дало им эволюционную нишу с ограниченным объемом и окруженную мембраной. Можно было обеспечить больший запас различных веществ, которые можно «складировать» не внутри ограниченного собственного объема, а снаружи, но в пределах своей «собственности», где они не будут разворованы другими организмами. Это соображение подтверждается в условиях, когда клетка вдруг перестает получать кислород и питательные вещества (например, при прекращении кровотока в участок ткани, что происходит при инфарктах и инсультах). Митохондрия в этих условиях уже не может быть энергетической машиной клетки (производить АТФ без кислорода трудно) и превращается в паразита — она начинает поглощать АТФ для того, чтобы обеспечить генерацию разницы мембранных потенциалов на своей мембране и поддержать свои собственные процессы. Для чего это нужно митохондрии — пока не понятно, но полуавтономный статус митохондрии в клетке тут проявляется особенно заметно — подобное поведение в кризисных условиях выглядит довольно эгоистичным. Не для того ли она производит АТФ в количествах, превышающих нужды клетки, чтобы обеспечить себе «подушку безопасности» в условиях кризиса?
Попадание бактерий во внутриклеточную нишу обеспечивало и защиту от внешних врагов (а основные враги для бактерии — вирусы, то есть фаги). При этом было позволено выпускать сигнальные защитные вещества в ограниченный внутриклеточный объем; когда же бактерии существовали в «океане», выпуск таких сигнальных веществ был нерациональным — они немедленно разбавлялись в нем. Жизнь внутриклеточных бактерий в этой нише дала определенные преимущества: бактерии производят энергию и организуют в своей мембране белок, который выбрасывает в цитоплазму клетки синтезированный АТФ, чем клетка и пользуется. В итоге вроде бы наступает баланс: клетка дает митохондрии питательные субстраты, митохондрия дает клетке энергию,— что укрепляет теорию симбиотического взаимоотношения бактерий (они уже становятся митохондриями) с остальными частями клетки. Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики. Одним из родоначальников эндосимбиотической теории происхождения митохондрий можно считать русского ботаника Константина Мережковского, который в конце XIX — начале ХХ века предположил, что хлоропласты (структуры растительных клеток, отвечающие за фотосинтез) имеют бактериальное происхождение. Позже аналогичное предположение было сделано и для митохондрий.
Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики
Из сказанного видно, что понятие симбиоза и некоторого «эгоистического» поведения митохондрий довольно размыто. Да и идеалистическая картина симбиоза была «омрачена» в самом конце ХХ века открытием, что митохондрии, выпуская сигнальные молекулы, отдающие приказ на уничтожение клетки, отвечают за ее гибель. То есть вроде бы все по пословице «сколько волка ни корми...». Однако надо взглянуть на ситуацию с другой стороны. Нужна ли клеточная смерть организму? Да, но не для всех клеток. Это обязательный процесс для тех клеток, которые постоянно делятся — иначе будет разрастание ткани, которое может быть нежелательным. Принципиально это и для предотвращения и лечения различного опухолеобразования. А вот для тех клеток, которые не очень умеют делиться, например, для нейронов или кардиомиоцитов, смерть не полезна. Если же рассматривать этот вопрос с позиции самих митохондрий, это выглядит как почти неприкрытый шантаж: или ты обеспечиваешь меня всем, что я хочу, или я убью тебя. С позиции же организма, все хорошо, когда митохондрия убивает неправильную клетку, и плохо, если убивает хорошую и нужную.
Приведенные выше рассуждения — это явный конфликт эволюционной стратегии и человеческой логики, пытающейся оценить ситуацию с позиции субъекта, внутри которого живут существа, способные из друзей превратиться во врагов. Этот конфликт не мешает исследователям понимать, что митохондрия, хоть она и «помнит», что была бактерией, активно участвует в функционировании клетки; важная роль митохондрий объясняет необходимость предоставления им привилегий. В определенных условиях они превращаются в источник наследуемых или приобретенных заболеваний — в частности, тех, которыми занимается митохондриальная медицина. Таких заболеваний — очень тяжелых и почти не поддающихся лечению — больше сотни. Да и помимо них есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий. Существуют теории митохондриального происхождения рака, болезни Паркинсона, Альцгеймера и других — с весьма достойным научным подтверждением.
Есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий
Сегодня выяснилось, что большинство болезней сопровождается сбоем в работе внутриклеточной машины проверки качества митохондрий, своеобразного ОТК, отбраковывающего плохие митохондрии и отправляющего их на внутриклеточное переваривание (митофагию). Сбой возникает, например, при старении организма, и ОТК пропускает неправильные митохондрии. В результате в клетке начинают сосуществовать хорошие и плохие митохондрии. Когда же доля плохих превышает некоторый порог, наступает т. н. «фенотипическое проявление» болезни, которая до сих пор носила невидимый, латентный характер.
Можно сделать два вывода. Во-первых, без митохондрий ядерные клетки существовать не могут. Во-вторых, чтобы защитить клетку от поражения (чем бы оно ни было вызвано: химией, физикой или просто временем), надо «договориться» с митохондриями, то есть обеспечить им «достойное» существование. Это означает не только постоянную подпитку их активности за счет доставки питательных субстратов и кислорода, но и предоставление им своеобразной медицинской страховки, которая при необходимости обеспечит восстановление их структуры и функций и/или правильную утилизацию поврежденных митохондрий. Отсутствие утилизации поврежденных митохондриальных структур может привести к «заражению» здоровых структур, что непременно повлечет за собой заболевание.
Сейчас трансплантация органов стала вполне рутинной процедурой, хотя все еще сложной и дорогостоящей. Развивается и клеточная терапия, то есть пересадка стволовых клеток. А вот о возможности пересадки здоровых митохондрий говорить только начинают. Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка. Недавно для лечения последствий инсульта головного мозга оказалось достаточным обеспечить должное функционирование митохондрий почек. То есть налицо «разговоры» (по-английски это звучит более научно — cross-talk) между органами, и почка со своими митохондриями помогает восстановлению головного мозга.
Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка
На каком языке «общаются» органы, еще предстоит выяснить, — пока предполагают химический язык общения. Хорошая и здоровая почка со своими здоровыми митохондриями вырабатывает и посылает в кровь эритропоэтин (тот самый, приемом которого увлекались спортсмены и который не только стимулирует выработку эритроцитов, но и мобилизует общий метаболизм, что повышает выносливость). Эритропоэтин обладает сильными нейрозащитными свойствами. Стоит повредить почку, скажем, неумеренным приемом антибиотиков (антибиотики убивают и митохондрии, потому что они — бывшие бактерии), и последствия инсульта головного мозга становятся более драматическими. Так на базе фундаментальных открытий начинает просматриваться стратегия лечения болезней.
Возьмем, к примеру, сепсис — бактериальную инфекцию, одну из ведущих причин человеческой смертности. Сейчас уже можно — правда, пока шепотом — говорить и о «митохондриальном сепсисе», когда в кровь попадают компоненты митохондрий. Это не менее опасно, чем бактериальный сепсис, так как приводит к гиперактивации иммунного ответа (так называемый синдром системного воспаления, SIRS) и возможной гибели организма.
Как уже было упомянуто, естественными врагами бактерий являются вирусы. Это также верно и для митохондрий. Недавно открытая бактериальная система защиты от вирусов CRISPR (clustered regularly interspaced short palindromic repeats), имеющая все признаки элементарно организованной иммунной системы, заставила задуматься: нет ли иммунной системы у митохондрий? У бактерий эта иммунная система устроена следующим образом: в бактериальном геноме (структурно очень похожем на митохондриальный) располагаются своего рода библиотеки, или антивирусные базы данных — куски генов тех вирусов, с которыми эта бактерия когда-либо встречалась. При считывании информации с этих участков синтезируются так называемые малые РНК. Эти РНК связываются с внедрившимися в бактерию вирусными нуклеиновыми кислотами, а затем такой комплекс расщепляется внутрибактериальными ферментами с нейтрализацией вируса. В чистом виде подобных структур в митохондриальном геноме обнаружено не было, кроме одного-единственного случая, описанного еще на заре исследования CRISPR-системы. Однако мы обнаружили отдельные случаи включения вирусных последовательностей в митохондриальный геном (вирусов гепатита B и гриппа), хотя и довольно редкие для того, чтобы говорить о системе. С другой стороны, наибольшее количество различных структур в геноме мы обнаружили в митохондриях растений, чей геном в разы больше митохондриального генома животных. Это особенно любопытно, учитывая, что растения в целом гораздо больше полагаются на противовирусную защиту на основе интерферирующих РНК, чем животные, поскольку не обладают особыми иммунными клетками, свободно перемещающимися по организму в кровотоке. Кроме того, не стоит забывать, что митохондрии делегируют значительную часть функций клетке, включая передачу части своего генетического материала в клеточное ядро, оставляя себе только «контрольный пакет акций», обеспечивающий их контроль над ключевыми функциями. Вполне возможно, что подобные клеточные библиотеки также были переданы в ядро — явление передачи малых РНК из цитоплазмы внутрь митохондрий известно. А значит, среди них могут быть и иммунные РНК. С другой стороны, возможно, что митохондрии полностью передали функции защиты клетке, довольствуясь возможностью убить клетку, которая их плохо защищает.
Приняв тезис «митохондрии помнят, что они были бактериями», мы можем поменять многое в стратегии базового научного мышления и практической медицинской деятельности, так или иначе связанных с митохондриями. А учитывая количество функций, выполняемых митохондриями в клетке, это большая часть всех биомедицинских задач: от рака до нейродегенеративных заболеваний.
elementy.ru
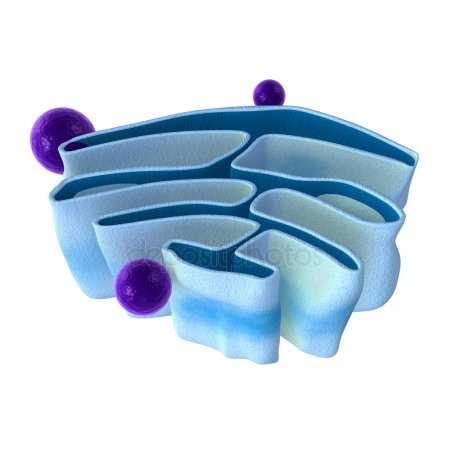
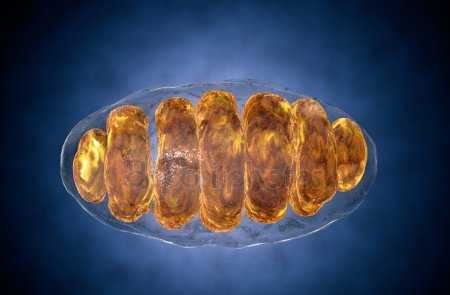
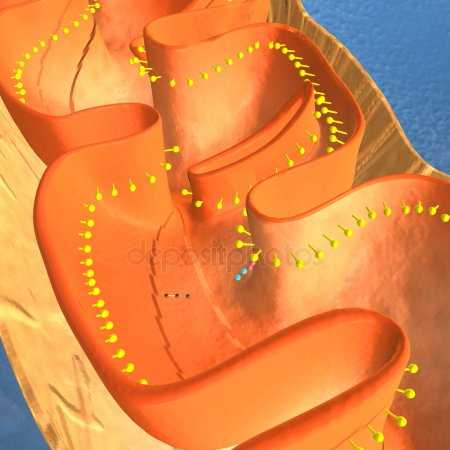
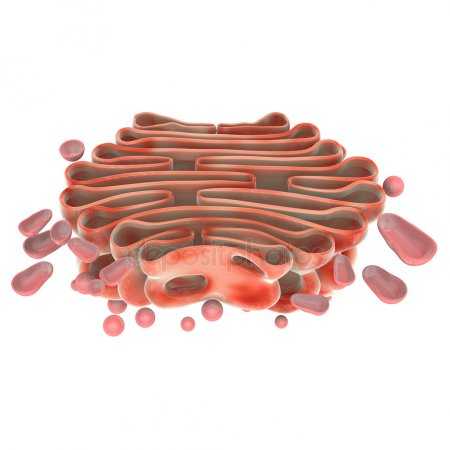
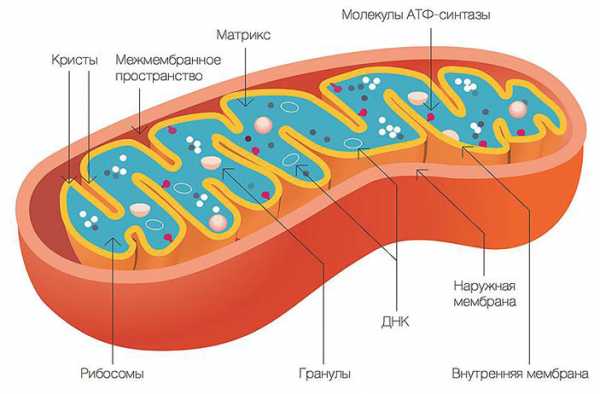
 Схема строения митохондрии
Схема строения митохондрии Наружная мембрана митохондрии имеет толщину около 7 нм, не образует впячиваний и складок и замкнута сама на себя. На наружную мембрану приходится около 7% площади поверхности всех мембран клеточных органелл. Основная функция — отграничение митохондрии от цитоплазмы. Наружная мембрана митохондрии состоит из липидов с вкраплениями белков (соотношение 2 : 1). Особую роль играет порин — каналообразующий белок. Он образует в наружной мембране отверстия диаметром 2-3 нм, через которые могут проникать небольшие молекулы и ионы весом до 5 кДа. Крупные молекулы могут проникать сквозь наружную мембрану только посредством активного транспорта с помощью транспортных белков митохондриальных мембран. Для наружной мембраны характерно присутствие ферментов: монооксигеназы, ацил-СоА-синтетазы и фосфолипазы А2. Наружная мембрана митохондрии может взаимодействовать с мембраной эндоплазматического ретикулума; это играет важную роль в транспортировке липидов и ионов кальция.
Межмембранное пространство представляет собой пространство между наружной и внутренней мембранами митохондрии. Его размер — 10-20 нм. Так как наружная мембрана митохондрии проницаема для небольших молекул и ионов, их концентрация в периплазматическом пространстве мало отличается от таковой в цитоплазме. Крупным же белкам для транспорта из цитоплазмы в периплазматическое пространство необходимо иметь специфические сигнальные пептиды; поэтому белковые компоненты периплазматического пространства и цитоплазмы различны. Одним из белков, содержащихся не только во внутренней мембране, но и в периплазматическом пространстве, является цитохром c.
Внутренняя мембрана состоит в основном из белковых комплексов (соотношение белок/липид — 3:1) и образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь её поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолипина — особого фосфолипида, содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов. Ещё одна особенность внутренней мембраны митохондрий — очень высокое содержание белков (до 70 % по весу), представленных транспортными белками, ферментами дыхательной цепи, а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Матрикс — ограниченное внутренней мембраной пространство. В матриксе (розовом веществе) митохондрии находятся ферментные системы окисления пирувата, жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии.
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу, в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 105 раз меньше ДНК, локализованной в ядре. В целом митохондриальная ДНК кодирует 2 рРНК, 22 тРНК и 13 субъединиц ферментов дыхательной цепи, что составляет не более половины обнаруживаемых в ней белков. В частности, под контролем митохондриального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с-редуктазы. При этом все белки, кроме одного, две рибосомные и шесть транспортных РНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Митохондриальная ДНК реплицируется в интерфазе, что частично синхронизировано с репликацией ДНК в ядре. Во время же клеточного цикла митохондрии делятся надвое путём перетяжки, образование которой начинается с кольцевой бороздки на внутренней митохондриальной мембране. Детальное изучение нуклеотидной последовательности митохондриального генома позволило установить то, что в митохондриях животных и грибов нередки отклонения от универсального генетического кода. Так, в митохондриях человека кодон ТАТ вместо изолейцина в стандартном коде кодирует аминокислоту метионин, кодоны ТСТ и ТСС, обычно кодирующие аргинин, являются стоп-кодонами, а кодон АСТ, в стандартном коде являющийся стоп-кодоном, кодирует аминокислоту метионин. Что касается митохондрий растений, то по-видимому, они используют универсальный генетический код. Другой чертой митохондрий является особенность узнавания кодонов тРНК, заключающаяся в том, что одна подобная молекула способна узнавать не один, но сразу три или четыре кодона. Указанная особенность снижает значимость третьего нуклеотида в кодоне и приводит к тому, что митохондрии требуется меньшее разнообразие типов тРНК. При этом достаточным количеством оказываются всего 22 различных тРНК.
Имея собственный генетический аппарат, митохондрия обладает и собственной белоксинтезирующей системой, особенностью которой в клетках животных и грибов являются очень маленькие рибосомы, характеризуемые коэффициентом седиментации 55S, что даже ниже аналогичного показателя у 70S-рибосом прокариотического типа. При этом две большие рибосомные РНК также имеют меньшие размеры, чем у прокариот, а малая рРНК вообще отсутствует. В митохондриях растений, напротив, рибосомы более сходны с прокариотическими по размерам и строению.
В специализированных (не делящихся) клетках митохондрии обычно не делятся. Обновление пула митохондрий в этом случае происходит путём созревания митохондрий из протомитохондрий, имеющих исходно диаметр 0,1-0,2 микрона. Откуда берутся протомитохондрии неизвестно, но предполагается, что затравкой для них служит ДНК постмитохондрий, высвобождающаяся в цитоплазму. Протомитохондрии обладают высокой скоростью дыхания, но невысоким дыхательным контролем (Векшин Н. Л. и др. 2004—2014).
Одной из основных функций митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций гликолиза шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально декарбоксилируется и превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно так же жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацил-СоА-производных и подвергаются бета-окислению с образованием ацетил-СоА.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие распад ацетил-СоА на два атома углерода, в виде СО2. Этот процесс обеспечивает образование одной молекулы ГТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13 кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего как минимум из 26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (флавинмононуклеотид — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (Qh3).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (цитохром bc1). Последний представляет собой димер с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в виде железосерных центров, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию окисления двух убихинолов до убихинонов, восстанавливая две молекулы цитохрома c (гемсодержащий переносчик, находящегося в межмембранном пространстве). Отщепляющиеся при этом от убихинолов четыре протона освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0 входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
org-wikipediya.ru
Реферат на тему:
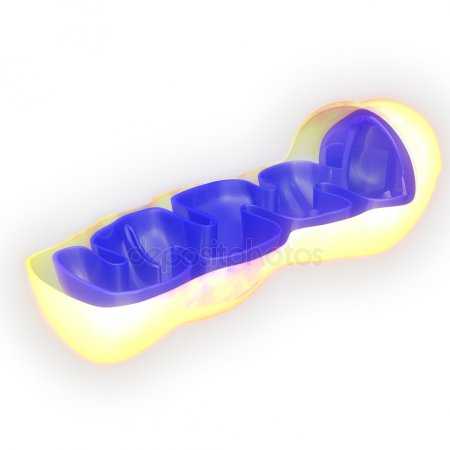
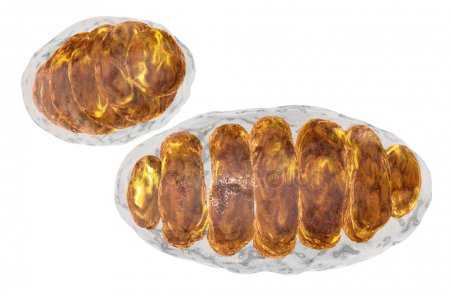
Электронномикроскопическая фотография, показывающая митохондрии млекопитающего в поперечном сечении
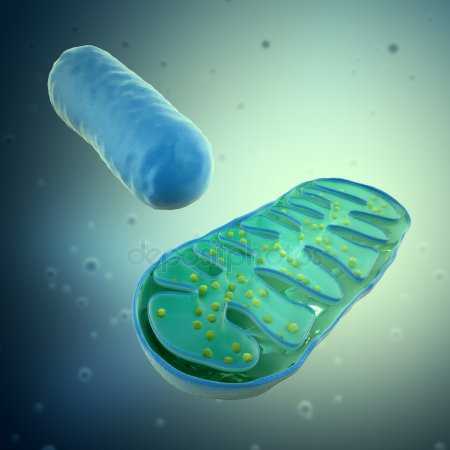
Митохондрия (от греч. μίτος — нить и χόνδρος — зёрнышко, крупинка) — двумембранная гранулярная или нитевидная органелла толщиной около 0,5 мкм. Характерна для большинства эукариотических клеток как аутотрофов (фотосинтезирующие растения), так и гетеротрофов (грибы, животные). Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии в синтезе молекул АТФ, который происходит за счёт движения электрона по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли (эвглена, хлорелла, политомелла) и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300000 и 500000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют.
В соответствии с теорией симбиогенеза, митохондрии появились в результате того, что примитивные клетки (прокариоты), которые не могли сами использовать кислород для генерирования энергии и что накладывало серьёзные ограничения на возможности развития, захватывали бактерии (прогеноты), которые могли это делать. В процессе развития таких отношений прогеноты передали множество своих генов сформировавшемуся, благодаря повысившейся энергоэффективности, ядру теперь уже эукариот.[1] Вот почему современные митохондрии больше не являются самостоятельными организмами. Хотя их геном кодирует компоненты собственной системы синтеза белка, многие ферменты и белки, необходимые для их функции, кодируются хромосомами, синтезируются в клетке и только потом транспортируются в органеллы.
Впервые митохондрии обнаружены в виде гранул в мышечных клетках в 1850 году. Число митохондрий в клетке непостоянно. Их особенно много в клетках, в которых потребность в кислороде велика. По своему строению они представляют собой цилиндрические органеллы, встречающиеся в эукариотической клетке в количестве от нескольких сот до 1-2 тысяч и занимающие 10-20 % её внутреннего объёма. Сильно варьируют так же размеры (от 1 до 70 мкм) и форма митохондрий. При этом ширина этих органелл относительно постоянна (0,5-1 мкм). Способны изменять форму. В зависимости от того, в каких участках клетки в каждый конкретный момент происходит повышенное потребление энергии, митохондрии способны перемещаться по цитоплазме в зоны наибольшего энергопотребления, используя для движения структуры цитоскелета эукариотической клетки.
Альтернативой множеству разрозненных небольших митохондрий, функционирующих независимо друг от друга и снабжающих АТФ небольшие участки цитоплазмы, является существование длинных и разветвлённых митохондрий, каждая из которых может энергетически обеспечивать отдалённые друг от друга участки клетки (например, у одноклеточных зелёных водорослей Chlorella). Вариантом такой протяжённой системы может также являться упорядоченное пространственное объединение множества митохондрий (хондриом или митохондрион), обеспечивающее их кооперативную работу и встречающееся как у одноклеточных, так и у многоклеточных организмов. Особенно сложно этот тип хондриома устроен в скелетных мышцах млекопитающих, где группы гигантских разветвлённых митохондрий связаны друг с другом с помощью межмитохондриальных контактов (ММК). Последние образованы плотно прилегающими друг к другу наружными митохондриальными мембранами, в результате чего межмембранное пространство в этой зоне имеет повышенную электронную плотность. Особенно обильно ММК представлены в клетках сердечных мышц, где они связывают множественные отдельные митохондрии в согласованную работающую кооперативную систему.

Схема строения митохондрии
Наружная мембрана митохондрии имеет толщину около 7 нм, не образует впячиваний и складок, и замкнута сама на себя. На наружную мембрану приходится около 7 % от площади поверхности всех мембран клеточных органелл. Основная функция — отграничение митохондрии от цитоплазмы. Наружная мембрана митохондрии состоит из билипидного слоя и пронизывающих его белков; соотношение липидов и белков по массе — примерно 1:1. Особую роль играет порин — каналообразующий белок: он формирует в наружной мембране отверстия диаметром 2-3 нм, через которые могут проникать небольшие молекулы и ионы весом до 5 кДа. Крупные молекулы могут пересекать наружную мембрану только посредством активного транспорта через транспортные белки митохондриальных мембран. Для наружной мембраны характерно присутствие ферментов: монооксигеназы, ацил-СоА-синтетазы и фосфолипазы А2. Наружная мембрана митохондрии может взаимодействовать с мембраной эндоплазматического ретикулума; это играет важную роль в транспортировке липидов и ионов кальция.
Межмембранное пространство представляет собой пространство между наружной и внутренней мембранами митохондрии. Его толщина — 10-20 нм. Так как наружная мембрана митохондрии проницаема для небольших молекул и ионов, их концентрация в периплазматическом пространстве мало отличается от таковой в цитоплазме. Напротив, крупным белкам для транспорта из цитоплазмы в периплазматическое пространство необходимо иметь специфические сигнальные пептиды; поэтому белковые компоненты периплазматического пространства и цитоплазмы различны. Одним из белков, содержащихся в периплазматическом пространстве, является цитохром c — один из компонентов дыхательной цепи митохондрий.
Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь ее поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолопина — особого фосфолипида, содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов. Ещё одна особенность внутренней мембраны митохондрий — очень высокое содержание белков (до 70 % по весу), представленных транспортными белками, ферментами дыхательной цепи, а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Матрикс — ограниченное внутренней мембраной пространство. В матриксе митохондрии находятся ферментные системы окисления пирувата жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии.
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу, в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 105 раз меньше ДНК, локализованной в ядре. В целом митохондриальная ДНК кодирует 2 рРНК, 22 тРНК и 13 субъединиц ферментов дыхательной цепи, что составляет не более половины обнаруживаемых в ней белков. В частности, под контролем митохондрального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с-редуктазы. При этом все белки, кроме одного, две рибосомные и шесть тРНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Митохондриальная ДНК реплицируется в интерфазе, что частично синхронизировано с репликацией ДНК в ядре. Во время же клеточного цикла митохондрии делятся надвое путём перетяжки, образование которой начинается с кольцевой бороздки на внутренней митохондриальной мембране. Детальное изучение нуклеотидной последовательности митохондриального генома позволило установить то, что в митохондриях животных и грибов нередки отклонения от универсального генетического кода. Так, в митохондриях человека кодон ТАТ вместо изолейцина в стандартном коде кодирует аминокислоту метионин, кодоны ТСТ и ТСС, обычно кодирующие аргинин, являются стоп-кодонами, а кодон АСТ, в стандартном коде являющийся стоп-кодоном, кодирует аминокислоту метионин. Что касается митохондрий растений, то, по-видимому, они используют универсальный генетический код. Другой чертой митохондрий является особенность узнавания кодонов тРНК, заключающаяся в том, что одна подобная молекула способна узнавать не один, но сразу три или четыре кодона. Указанная особенность снижает значимость третьего нуклеотида в кодоне и приводит к тому, что митохондрии требуется меньшее разнообразие типов тРНК. При этом достаточным количеством оказываются всего 22 различных тРНК.
Имея собственный генетический аппарат, митохондрия обладает и собственной белоксинтезирующей системой, особенностью которой в клетках животных и грибов являются очень маленькие рибосомы, характеризуемые коэффициентом седиментации 55S, что даже ниже аналогичного показателя у 70s-рибосом прокариотического типа. При этом две большие рибосомные РНК также имеют меньшие размеры, чем у прокариот, а малая рРНК вообще отсутствует. В митохондриях растений, напротив, рибосомы более сходны с прокариотическими по размерам и строению.
Количество транслируемых с митохондриальной мРНК белков, формирующих субъединицы крупных ферментных комплексов, ограниченно. Значительная часть белков кодируется в ядре и синтезируется на цитоплазматических 80S рибосомах. В частности, так образуются некоторые белки — переносчики электронов, митохондриальные транслоказы, компоненты транспорта белков в митохондрии, а также факторы, необходимые для транскрипции, трансляции и репликации митохондриальной ДНК. При этом подобные белки на своём N-конце имеют особые сигнальные пептиды, размер которых варьирует от 12 до 80 аминокислотных остатков. Данные участки формируют амфифильные завитки, обеспечивают специфический контакт белков со связывающими доменами митохондриальных распознающих рецепторов, локализованных на наружной мембране. До наружной мембраны митохондрии данные белки транспортируются в частично развёрнутом состоянии в ассоциации с белками-шаперонами (в частности — с hsp70). После переноса через наружную и внутреннюю мембраны в местах их контактов поступающие в митохондрию белки вновь связываются с шаперонами, но уже собственного митохондриального происхождения, которые подхватывают пересекающий мембраны белок, способствуют его втягиванию в митохондрию, а также контролируют процесс правильного сворачивания полипептидной цепи. Большинство шаперонов обладает АТФазной активностью, в результате чего как транспорт белков в митохондрию, так и образование их функционально активных форм являются энергозависимыми процессами.
Основной функцией митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента протонов водорода. Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно также жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацетил-СоА-производных.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие укорочение углеводородной цепи на два атома углерода, которые в дальнейшем превращаются в СО2. Этот процесс обеспечивает образование одной молекулы АТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего из 16-26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (Фл — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (Qh3).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде особого вида — электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (bc1). Последний представляет собой димер из субъединиц b и c1 с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в серных ячейках, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию восстановления убихинола до убихинона с передачей электронов на атом железа второй молекулы переносчика (находящегося в межмембранном пространстве цитохрома c). Отщепляющиеся при этом от убихинола два протона водорода освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента. Наконец, ещё два протона водорода переносятся в межмембранное пространство митохондрии за счёт энергии электронов, проходящих по простетических группам комплекса III.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтетазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
В структурно-функциональном плане АТФ-синтетаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в торону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтетазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0 входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтетазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтетазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
Таким образом, каталитическая активность АТФ-синтетазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтетазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтетазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтетазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
ДНК митохондрий наследуются почти исключительно по материнской линии. Каждая митохондрия имеет несколько участков нуклеотидов в ДНК, идентичных во всех митохондриях (то есть в клетке много копий митохондриальных ДНК), что очень важно для митохондрий, неспособных восстанавливать ДНК от повреждений (наблюдается высокая частота мутаций). Мутации в митохондриальной ДНК являются причиной целого ряда наследственных заболеваний человека.
wreferat.baza-referat.ru
Митохо́ндрия (от греч. μίτος — нить и χόνδρος — зёрнышко, крупинка) — двумембранная гранулярная или нитевидная органелла толщиной около 0,5 мкм. Характерна для большинства эукариотических клеток как автотрофов (фотосинтезирующие растения), так и гетеротрофов (грибы, животные). Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии в синтезе молекул АТФ, который происходит за счёт движения электрона по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли (эвглена, хлорелла, политомелла) и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют.
В соответствии с теорией симбиогенеза, митохондрии появились в результате захвата примитивными клетками (прокариотами) бактерий. Клетки, которые не могли сами использовать кислород для генерации энергии, имели серьёзные ограничения в возможностях развития; бактерии же (прогеноты) могли это делать. В процессе развития таких отношений прогеноты передали множество своих генов сформировавшемуся, благодаря повысившейся энергоэффективности, ядру теперь уже эукариот.[1] Вот почему современные митохондрии больше не являются самостоятельными организмами. Хотя их геном кодирует компоненты собственной системы синтеза белка, многие ферменты и белки, необходимые для их функции, кодируются хромосомами, синтезируются в клетке и только потом транспортируются в органеллы.
Впервые митохондрии обнаружены в виде гранул в мышечных клетках в 1850 году. Число митохондрий в клетке непостоянно. Их особенно много в клетках, в которых потребность в кислороде велика. По своему строению они представляют собой цилиндрические органеллы, встречающиеся в эукариотической клетке в количестве от нескольких сот до 1-2 тысяч и занимающие 10-20 % её внутреннего объёма. Сильно варьируют так же размеры (от 1 до 70 мкм) и форма митохондрий. При этом ширина этих органелл относительно постоянна (0,5-1 мкм). Способны изменять форму. В зависимости от того, в каких участках клетки в каждый конкретный момент происходит повышенное потребление энергии, митохондрии способны перемещаться по цитоплазме в зоны наибольшего энергопотребления, используя для движения структуры цитоскелета эукариотической клетки.
Альтернативой множеству разрозненных небольших митохондрий, функционирующих независимо друг от друга и снабжающих АТФ небольшие участки цитоплазмы, является существование длинных и разветвлённых митохондрий, каждая из которых может энергетически обеспечивать отдалённые друг от друга участки клетки (например, у одноклеточных зелёных водорослей Chlorella). Вариантом такой протяжённой системы может также являться упорядоченное пространственное объединение множества митохондрий (хондриом или митохондрион), обеспечивающее их кооперативную работу и встречающееся как у одноклеточных, так и у многоклеточных организмов. Особенно сложно этот тип хондриома устроен в скелетных мышцах млекопитающих, где группы гигантских разветвлённых митохондрий связаны друг с другом с помощью межмитохондриальных контактов (ММК). Последние образованы плотно прилегающими друг к другу наружными митохондриальными мембранами, в результате чего межмембранное пространство в этой зоне имеет повышенную электронную плотность. Особенно обильно ММК представлены в клетках сердечных мышц, где они связывают множественные отдельные митохондрии в согласованную работающую кооперативную систему.
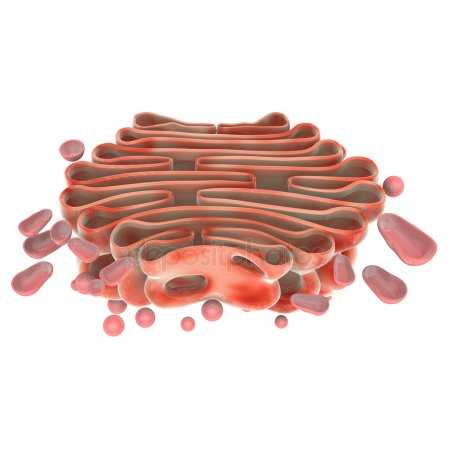
 Схема строения митохондрии
Схема строения митохондрии Наружная мембрана митохондрии имеет толщину около 7 нм, не образует впячиваний и складок, и замкнута сама на себя. На наружную мембрану приходится около 7 % от площади поверхности всех мембран клеточных органелл. Основная функция — отграничение митохондрии от цитоплазмы. Наружная мембрана митохондрии состоит из билипидного слоя и пронизывающих его белков; соотношение липидов и белков по массе — примерно 1:1. Особую роль играет порин — каналообразующий белок: он формирует в наружной мембране отверстия диаметром 2-3 нм, через которые могут проникать небольшие молекулы и ионы весом до 5 кДа. Крупные молекулы могут пересекать наружную мембрану только посредством активного транспорта через транспортные белки митохондриальных мембран. Для наружной мембраны характерно присутствие ферментов: монооксигеназы, ацил-СоА-синтетазы и фосфолипазы А2. Наружная мембрана митохондрии может взаимодействовать с мембраной эндоплазматического ретикулума; это играет важную роль в транспортировке липидов и ионов кальция.
Межмембранное пространство представляет собой пространство между наружной и внутренней мембранами митохондрии. Его толщина — 10-20 нм. Так как наружная мембрана митохондрии проницаема для небольших молекул и ионов, их концентрация в периплазматическом пространстве мало отличается от таковой в цитоплазме. Напротив, крупным белкам для транспорта из цитоплазмы в периплазматическое пространство необходимо иметь специфические сигнальные пептиды; поэтому белковые компоненты периплазматического пространства и цитоплазмы различны. Одним из белков, содержащихся в периплазматическом пространстве, является цитохром c — один из компонентов дыхательной цепи митохондрий.
Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь ее поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолипина — особого фосфолипида, содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов. Ещё одна особенность внутренней мембраны митохондрий — очень высокое содержание белков (до 70 % по весу), представленных транспортными белками, ферментами дыхательной цепи, а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Матрикс — ограниченное внутренней мембраной пространство. В матриксе (розовом веществе) митохондрии находятся ферментные системы окисления пирувата, жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии.
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу, в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 105 раз меньше ДНК, локализованной в ядре. В целом митохондриальная ДНК кодирует 2 рРНК, 22 тРНК и 13 субъединиц ферментов дыхательной цепи, что составляет не более половины обнаруживаемых в ней белков. В частности, под контролем митохондрального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с-редуктазы. При этом все белки, кроме одного, две рибосомные и шесть тРНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Митохондриальная ДНК реплицируется в интерфазе, что частично синхронизировано с репликацией ДНК в ядре. Во время же клеточного цикла митохондрии делятся надвое путём перетяжки, образование которой начинается с кольцевой бороздки на внутренней митохондриальной мембране. Детальное изучение нуклеотидной последовательности митохондриального генома позволило установить то, что в митохондриях животных и грибов нередки отклонения от универсального генетического кода. Так, в митохондриях человека кодон ТАТ вместо изолейцина в стандартном коде кодирует аминокислоту метионин, кодоны ТСТ и ТСС, обычно кодирующие аргинин, являются стоп-кодонами, а кодон АСТ, в стандартном коде являющийся стоп-кодоном, кодирует аминокислоту метионин. Что касается митохондрий растений, то, по-видимому, они используют универсальный генетический код. Другой чертой митохондрий является особенность узнавания кодонов тРНК, заключающаяся в том, что одна подобная молекула способна узнавать не один, но сразу три или четыре кодона. Указанная особенность снижает значимость третьего нуклеотида в кодоне и приводит к тому, что митохондрии требуется меньшее разнообразие типов тРНК. При этом достаточным количеством оказываются всего 22 различных тРНК.
Имея собственный генетический аппарат, митохондрия обладает и собственной белоксинтезирующей системой, особенностью которой в клетках животных и грибов являются очень маленькие рибосомы, характеризуемые коэффициентом седиментации 55S, что даже ниже аналогичного показателя у 70s-рибосом прокариотического типа. При этом две большие рибосомные РНК также имеют меньшие размеры, чем у прокариот, а малая рРНК вообще отсутствует. В митохондриях растений, напротив, рибосомы более сходны с прокариотическими по размерам и строению.
Количество транслируемых с митохондриальной мРНК белков, формирующих субъединицы крупных ферментных комплексов, ограниченно. Значительная часть белков кодируется в ядре и синтезируется на цитоплазматических 80S рибосомах. В частности, так образуются некоторые белки — переносчики электронов, митохондриальные транслоказы, компоненты транспорта белков в митохондрии, а также факторы, необходимые для транскрипции, трансляции и репликации митохондриальной ДНК. При этом подобные белки на своём N-конце имеют особые сигнальные пептиды, размер которых варьирует от 12 до 80 аминокислотных остатков. Данные участки формируют амфифильные завитки, обеспечивают специфический контакт белков со связывающими доменами митохондриальных распознающих рецепторов, локализованных на наружной мембране. До наружной мембраны митохондрии данные белки транспортируются в частично развёрнутом состоянии в ассоциации с белками-шаперонами (в частности — с hsp70). После переноса через наружную и внутреннюю мембраны в местах их контактов поступающие в митохондрию белки вновь связываются с шаперонами, но уже собственного митохондриального происхождения, которые подхватывают пересекающий мембраны белок, способствуют его втягиванию в митохондрию, а также контролируют процесс правильного сворачивания полипептидной цепи. Большинство шаперонов обладает АТФазной активностью, в результате чего как транспорт белков в митохондрию, так и образование их функционально активных форм являются энергозависимыми процессами.
Основной функцией митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента (англ.)русск. протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно также жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацетил-СоА-производных.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие укорочение углеводородной цепи на два атома углерода, которые в дальнейшем превращаются в СО2. Этот процесс обеспечивает образование одной молекулы ГТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13 кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего из 16-26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (Фл — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (Qh3).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде особого вида — электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (bc1). Последний представляет собой димер из субъединиц b и c1 с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в серных ячейках, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию восстановления убихинола до убихинона с передачей электронов на атом железа второй молекулы переносчика (находящегося в межмембранном пространстве цитохрома c). Отщепляющиеся при этом от убихинола два протона водорода освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента. Наконец, ещё два протона водорода переносятся в межмембранное пространство митохондрии за счёт энергии электронов, проходящих по простетических группам комплекса III.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтетазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0 входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтетазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
ДНК митохондрий наследуются почти исключительно по материнской линии. Каждая митохондрия имеет несколько участков нуклеотидов в ДНК, идентичных во всех митохондриях (то есть в клетке много копий митохондриальных ДНК), что очень важно для митохондрий, неспособных восстанавливать ДНК от повреждений (наблюдается высокая частота мутаций). Мутации в митохондриальной ДНК являются причиной целого ряда наследственных заболеваний человека.
dvc.academic.ru










