Профилактическая вакцинация – введение в организм человека медицинских лекарств, для создания специфической невосприимчивости к инфекционным возбудителям. Используется с целью предупреждения, ограничения распространения и ликвидации болезней. Активная иммунизация проводится с использованием вакцин – веществ, получаемых из бактерий, вирусов, грибов, продуктов их жизнедеятельности.
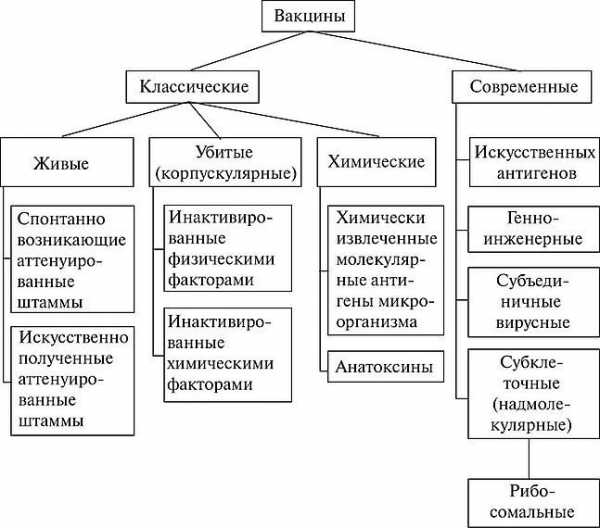
Классификация вакцин (фото: www.studref.com)
По свойствам и механизму действия выделяют следующие виды:
С их помощью можно предотвратить опасные болезни, защитить себя во время путешествий, минимизировать последствия недугов.
Синтез происходит на основе непатогенных для человека штаммов, которые несут антигены возбудителей. Включают только высокоиммуногенные компоненты, способствующие формированию защитного иммунитета. Они могут быть использованы для разработки комплексных медикаментов, создающих иммунитет против нескольких инфекций. Выпускаются как в сухом (лиофилизированном), так и в жидком виде вместе с консервантом.
Синтетические препараты содержат антигены возбудителей, приобретенные с внедрением основ генной инженерии. Их получают путем встраивания генетического материала возбудителя в геном других микроорганизмов (дрожжевые клетки, вирусы, бактерии, растения). После культивации (выращивания) выделяют готовый синтезированный антиген, очищают его и готовят действующее вещество.
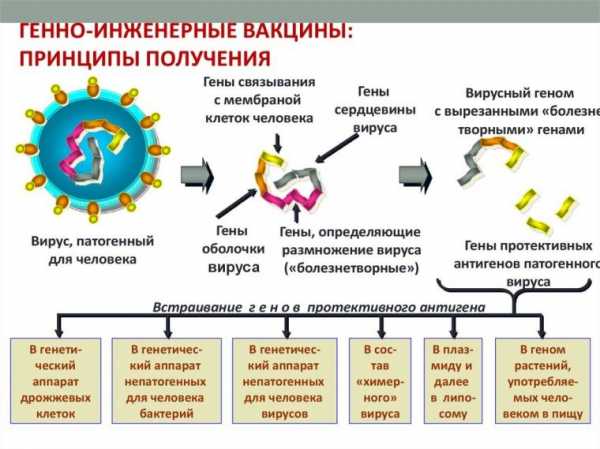
Основные принципы получения вакцин (фото: www.en.ppt-online.org)
Процесс приготовления состоит с нескольких этапов:
Используется второй путь получения рекомбинантных вакцин: непосредственное введение в организм клеток-продуцентов (синтезирующих определенные биологически активные соединения).
В состав вещества не входят живые возбудители и патогенные штаммы, поэтому вакцины не несут опасности для пациента. Но концентрация антигенов достаточная, чтобы вызвать иммунный ответ организма. В ответ на введение вещества происходит синтез защитных белков (антител), их концентрация постепенно нарастает. При повторном попадании чужеродных единиц активируется иммунная память, организм легко справляется с возбудителем, не дает развиться заболеванию. Формируется специфический активный иммунитет к патогенному возбудителю. Чтобы поддерживать высокий уровень антител, необходима повторная инъекция. Делают инъекцию двух- или трехкратно с четко установленным интервалом.
Основные показания к назначению рекомбинантных препаратов:
В особенности назначаются пациентам с повышенным риском развития болезни и отдаленных осложнений:
Важно! Допускается введение с первых дней жизни, но только по назначению врача
Каталог официально зарегистрированных в Российской Федерации рекомбинантных препаратов включает:
Они соответствуют современным нормам и рекомендациям ВОЗ.
Препараты используются для активной профилактики против гепатита В, ВПЧ (вируса папилломы человека), лихорадки Эбола, африканской катаральной лихорадки.
В официально зарегистрированный календарь входит только инъекция против гепатита В. Стандартная схема состоит с трех инъекций: в последующие 24 часа после рождения, в первый и шестой месяц.
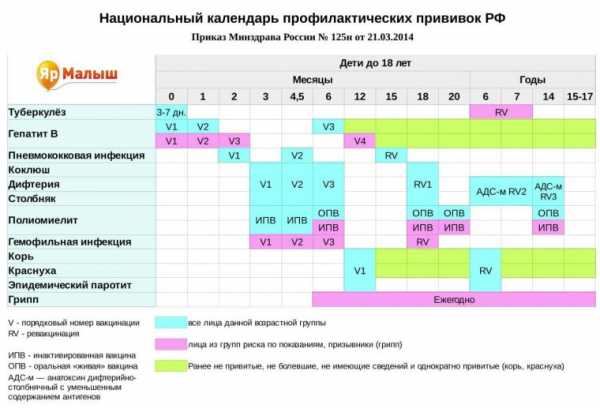
Национальный календарь профилактической вакцинации (фото: www.yarmalysh.ru)
Вещества предназначены для внутримышечного введения. Оптимальная область – дельтовидная мышца (верхняя треть наружной поверхности плеча). Маленьким детям (до года) рекомендуется вводить в переднебоковую бедренную область.
Запрещается делать инъекцию в ягодичную мышцу. Могут образовываться стерильные абсцессы (ограниченное воспаление тканей). Не допускается также внутривенное попадание вещества.
Существуют состояния, при которых не рекомендуется введение лекарственного вещества. Чтобы не навредить здоровью стоит, детально с ними ознакомиться. Все противопоказания делятся на постоянные и временные.
Абсолютные (с течением времени не отменяются):
Относительные (назначают в плановом порядке спустя определенное время):
При отсутствии вышеперечисленных состояний, нормализации температуры можно делать инъекцию.
Совет врача! Перед запланированной датой следует проконсультироваться с доктором, сдать анализ крови и мочи
Рекомбинантные препараты отличаются низкой реактогенностью (способностью вызывать осложнения и побочные реакции). Побочные эффекты связанны с вирулентностью штамма возбудителя, токсическими веществами, избыточным количеством белка.
В норме они возникают через несколько часов после инъекции, характеризуются транзиторным течением (проходят самостоятельно в течение нескольких дней). Не требуют специфического лечения, но можно применять симптоматическую терапию (жаропонижающие, обезболивающие, антигистаминные лекарства).
В месте инъекции могут возникать:
К системным проявлениям относят:
При повышенной чувствительности к составляющим компонентам может возникать анафилактический шок, который требует оказания экстренной помощи.
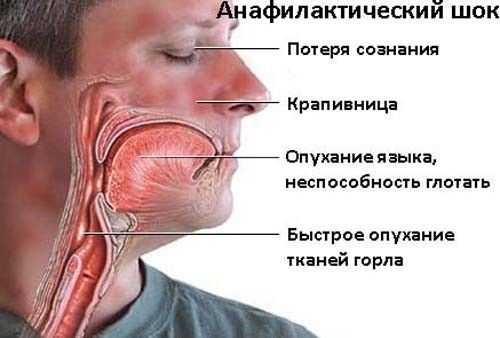
Клинические проявления анафилактического шока (фото: www.medicala.ru)
При неправильном введении вещества, несоблюдении правил стерильности могут возникать поствакцинальные осложнения. Они отличаются токсичностью и выраженным нарушением состояния пациента.
Наиболее часто возникают:
Для предупреждения развития осложнений проводят осмотр перед вакцинированием, консультацию доктора, соблюдают технику введения и выявления противопоказаний.
simptomyinfo.ru
Рекомбинантные (векторные) вакцины, полученные методами генной инженерии. Суть метода: гены вирулентного микроорганизма,отвечающий за синтез протективных антигенов, встраивают в геном какого - либо безвредного микроорганизма, который при культивировании продуцирует и накапливает соответствующий антиген. Примером может служить рекомбинантная вакцина против вирусного гепатита B, вакцина против ротавирусной инфекции. Наконец, имеются положительные результаты использования т.н. векторных вакцин, когда на носитель - живой рекомбинантный вирус осповакцины (вектор) наносятся поверхностные белки двух вирусов: гликопротеин D вируса простого герпеса и гемагглютинин вируса гриппа А. Происходит неограниченная репликация вектора и развивается адекватный иммунный ответ против вирусной инфекции обоих типов. Действие отдельных компонентов микробных, вирусных и паразитарных антигенов проявляется на разных уровнях и в разных звеньях иммунной системы. Их результирующая может быть лишь одна: клинические признаки заболевания - выздоровление - ремиссия - рецидив - обострение или другие состояния организма. Для производства этих вакцин применяют рекомбинантную технологию, встраивая генетический материал микроорганизма в дрожжевые клетки, продуцирующие антиген. После культивирования дрожжей из них выделяют нужный антиген, очищают и готовят вакцину. Примером таких вакцин может служить вакцина против гепатита .
Синтетические вакцины. Их создают путем биоорганического синтеза антигенных детерминант протективных вирусных белков. Получение таких вакцин возможно при полной расшифровке структуры (последовательности аминокислот) этих антигенных детерминант. Синтетические вакцины — это препараты, содержащие искусственно синтезированные короткие пептиды, имитирующие небольшие участки протективных антигенов вируса, способные вызвать специфический иммунный ответ организма и защитить его от конкретного заболевания. Для получения таких вакцин используют автоматические синтезаторы. Однако синтетические пептиды оказались слабыми антигенами, и для усиления иммуногенности они нуждаются в соединении с белком-носителем или синтетическим биополимером (мурамилпептид, сополимеры Д-глутамина и др.).Проблема, связанная с синтетическими пептидами, состоит в том, что многие антигенные вирусные детерминанты представляют собой не непрерывную последовательность аминокислот, а конформационные кислотные участки, собранные вместе благодаря пространственной организации белка. Для иммунного ответа конформация является очень важной. Циклизированные пептиды показали большую иммуногенность, чем их линейные аналоги.
Возможность использования синтетических пептидов для индукции иммунитета у животных впервые была показана на примере ящура. Это стало возможным после того, как было установлено, что за индукцию вируснейтрализующих антител вируса ящура ответственен белок VP-1. Позднее был синтезирован пептид, содержащий аминокислотные последовательности VP-1 (141 — 160), который связали с гемоцианином и адъювантом Фрейнда. Вакцину испытали на морских свинках, свиньях и крупном рогатом скоте. Вакцина защитила животных от заболевания при заражении их вирулентным штаммом вируса. Однако антительный ответ был в 10—100 раз ниже, чем после иммунизации цельными вирионами. Указанная вакцина не нашла широкого практического применения.
Получены обнадеживающие результаты применения синтетических вакцин против гриппа, гепатита В, полиомиелита и др.
ДНК-вакцины. Основой является бактериальная плазмида, способная эффективно размножаться в клетках. В плазмиду генно-инженерными методами встраивают «смысловой» ген, кодирующий иммунногенный белок того вируса, от которого будет защищать ДНК-вакцина. На практике используют модифицированную плазмиду цитомегаловируса или обезьяньего вируса 40, или вируса саркомы Рауса. В плазмиде есть ген устойчивости к антибиотику, необходимому для ее селекции при клонировании и выращивании. Результаты исследования на лаб.животных показали, что количество плазмиды, необходимой для вакцинации при в/м введении, может колебаться в пределах 0,001-10 мкг на 1 кг живой массы.
Днк-вакцины можно вводить внутрикожно, в/м, п/к,в/в,интраназально, орально. В настоящее время сконструировано более 20 таких вакцин против: бешенства, болезни Ауески, болезни Ньюкасла, инфеккционного ринотрахеита, вирусной диареи, СПИДа, герпесвирусных инфекциях человека и др. Перспективны ля профилактики болезней, склонных к длительному хроническому течению. Они обладают безопасностью инактивированных и эффективностью живых вакцин.
studfiles.net
Накоплены данные, свидетельствующие о преимуществах использования эукариотических систем экспресии, в частности дрожжей. Производство вирусных антигенов в дрожжах представляет пример эффективного использования гетерологичной системы для разработки технологии изготовления противовирусных вакцин. Дрожжи не только обладают способностью к росту с высокой плотностью популяции в суспензионной культуре в фер- ментарах, но и обеспечивают специфические модификации транслируемых рекомбинантных белков, чего не происходит в прокариотической системе. В итоге при использовании дрожжей оказалось возможным получить рекомбинантный вирусный белок с высокой специфической иммунологической активностью. Наглядным примером изготовления «дрожжевой» вакцины служит вакцина против гепатита В. Цель была достигнута трансформацией дрожжей рекомбинантной экспрессионной плазмидой, содержащей ген поверхностного антигена вируса гепатита В. Современная технология рекомбинантной ДНК пришла на смену устаревшей рутинной технологии изготовления вакцины против одного из наиболее опасных и широко распространенных заболеваний людей. Ранние вакцины против гепатита В были необычными и представляли собой очищенный поверхностный антиген вируса (HBsAg), полученный из плазмы крови человека, хронического носителя вируса. Это была уникальная в своем роде вакцина. Рекомбинантные дрожжевые клетки продуцируют поверхностный антиген вируса гепатита В, агрегированный в многомерные сферические частицы диаметром 22 нм, идентичные натуральному поверхностному HBsAg антигену, обнаруживаемому в плазме крови хронически инфицированных людей. HBsAg синтезировался в дрожжах в количестве, достаточном для промышленного изготовления вакцины. Антиген, выделенный из разрушенных дрожжей, очищают скоростным центрифугированием в сочетании с иммунной хроматографией. Сравнительный анализ физико-химических, морфологических и иммуно- генных свойств HBsAg, полученного генно-инженерным способом и выделенного из плазмы крови носителей вируса, продемонстрировал близость их характеристик. Однако поверхностный антиген вируса гепатита В, продуцируемый дрожжами, оказался негликозилированным. С целью усиления иммуногенности в рекомбинантные вакцины были включены, помимо HBsAg, белки, кодируемые зонами npe-S ДНК вируса гепатита В. Рекомбинантные культуры дрожжей, в отличие от плазмы носителей антигена вируса, практически представляют неограниченный источник вирусного антигена для изготовления вакцинного препарата. Протективная активность рекомбинантной вакцины не отличается от активности вакцины, полученной из плазмы крови доноров [1196]. В дрожжах экспрессирован G-белок вируса бешенства в нативном виде [1130]. Основной протективный белок VP2 вируса бурсальной болезни кур образовывался в высокоиммуногенной форме в рекомбинантных дрожжах. Рекомбинантный белок VP2 после однократного внутримышечного введения (-50 мкг) в составе эмульгированной вакцины вызывал у кур вируснейтрализующие антитела в таком же титре, как после введения живого вируса. Трансовариальная передача антител обеспечивала выраженный иммунитет у потомства и вселяла надежду на практическое применение такой вакцины [655]. Аналогичные результаты получены с рекомбинантной субъединичной вакциной, содержащей белок VP2, экспрессированный в бакуловирусной системе [1244, 1701]. Создание эффективной вакцины против гепатита С связано с многими проблемами, и в первую очередь, с отсутствием возможности размножения вируса в культуре клеток, а так же генетическим разнообразием и высоким уровнем мута- бильности вируса. Вакцины, основанные на гликопротеинах Е1 и Е2, вызывали кратковременное образование антител у обезьян к этим антигенам и требовали частой бустеризации. Привитые животные были защищены против внутривенного заражения малыми дозами вирулентного вируса гомологичной антигенности, но не против заражения большой дозой вируса или заражения гетерологич- ным штаммом вируса. Возможно, что для усиления протективного эффекта требуется индукция специфических цитотоксических лимфоцитов к консервативным эпитопам неструктурных белков [989]. Возрастающий интерес к изготовлению компонентных вакцин на основе технологии рекомбинантной ДНК привлек внимание к использованию клеток животных в качестве систем, экспрессирующих рекомбинантные вирусные белки. В качестве таких систем часто использовали трансформированные линии клеток, в том числе яичника китайского хомяка (линия СНО), а также клетки обезьян, трансформированные вирусом SV-40 (линия COS). Такую систему использовали для наработки антигенов, вируса гепатита В и др. Продуцируемые в рекомбинантных клетках СНО вирусоподобные частицы, содержащие поверхностный антиген вируса гепатита В, имели диаметр 22 нм, плотность в хлориде цезия 1,21 г/см3 и не отличались от частиц, обнаруживаемых в плазме крови инфицированных носителей. Культуральные свойства клеток СНО позволяли рассчитывать на их промышленное использование в качестве продуцентов иммуно- генного материала [934]. Клетки гепатобластомы человека (линия HepG2), трансфицированные полноразмерной ДНК вируса гепатита В, в большом количестве секретировали антигены Е, С и S [1320]. Мембранный гликопротеин (340/220) вируса Эпштейн- Барр длительное время экспрессировался в фибрабластоподобных клетках мышей, трансформированных вирусом папилломы крупного рогатого скота [528]. Белок Е1 вируса краснухи был экспрессирован в клетках COS после трансфекции клеток кДНК в составе вектора обезьяньего вируса SV-40. Этот белок антигенно подобен белку, экспрессируемому в клетках, зараженных вирусом краснухи [1146]. Генно-инженерным методом получена клеточная линия, продуцирующая пустые капсиды парвовируса В-19 человека. Продукция полых капсидов была равной или превышала формирование вирионов в инфицированных клетках костного мозга (1000—2000 капсидов на клетку). Трансфекция не влияла на скорость роста клеток-продуцентов [867]. Капсиды парвовируса В-19, экспрессированные в бакуловирусной системе, по антигенным и иммуногенным свойствам были подобны нативным вирионам [868]. Испытание рекомбинантной вакцины на серонегативных добровольцах дало положительные результаты [527]. Получен рекомбинантный вирус бешенства, стабильно экспрессирующий гликопротеин оболочки др 160 вируса иммунодефицита человека 1. Этот вирус вызывал у мышей образование ВН-антител в высоком титре (1:800) и мог служить прообразом рекомбинантной вакцины против ВИЧ-1 [1386]. Живые вакцины против краснухи весьма эффективны, однако их реактоген- ность, особенно для беременных женщин, побудила к созданию новых средств специфической профилактики краснухи. Новая стратегия основывалась на создании компонентных вакцин на основе рекомбинантной ДНК-технологии. Получена субъединичная вакцина, которая включает белок Е1, содержащий главные нейтрализующие эпитопы [921]. Клетки куриного эмбриона, трансфицированные геном HN вируса Ньюкаслской болезни в составе вектора из вируса саркомы Рауса, стабильно экспрессировали белок HN на клеточной поверхности; адсорбировали эритроциты кур и проявляли нейраминидазную активность. Трансфицированные HN-клетки проявляли резистентность к суперинфекции вирусами ньюкаслской болезни и гриппа, связывающимися с рецепторами, содержащими сиаловую кислоту, но были чувствительны к заражению вирусом везикулярного стоматита [1100]. Протективный поверхностный гликопротеин D вируса простого герпеса, экспрессируемый и секретируемый клетками СНО, вызывал синтез нейтрализующих антител и защиту мышей от заражения летальной дозой вируса [1131]. Обработка морских свинок гликопротеином вместе с адъювантом предупреждала развитие латентной инфекции ганглиев и оказывала терапевтический эффект, снижая количество и тяжесть вирусиндуцированных повреждений. Субъединичные вакцины, содержащие HN и F гликопротеины вируса ПГ-3, получены из очищенного вируса или в культуре клеток насекомых, инфицированных рекомбинантным бакуловирусом, экспрессирующим HN и F белки, или химерным вирусом. Рекомбинантная субъединичная вакцина против лейкоза кошек в качестве антигена содержала негликозилированный гликопротеин оболочки вируса лейкемии кошек подгруппы А. Такой рекомбинантный белок включал белок оболочки (гликопротеин 70 кД) и первые 34 аминокислоты трансмембранного белка Р15Е. Вакцина представляла собой очищенный белок, адсорбированный на гидроокиси алюминия, и содержала сапонин. У вакцинированных кошек образовывались вируснейтрализующие антитела и развивалась анамнестическая реакция на введение вируса лейкемии кошек. Иммунизированные животные были защищены от вирусной инфекции [1007]. Постоянные линии клеток имеют важные преимущества в качестве субстратов для производства рекомбинантных субъединичных вакцин. Поскольку такиеклетки являются естественным хозяином вирусов млекопитающих и птиц, синтезируемые в них рекомбинантные вирусные белки во всех отношениях подобны природным вирусным антигенам. Выделение и очистка таких антигенов отличаются быстротой и экономичностью. Наработка протективных вирусных антигенов в эукариотических системах, по-видимому, является наиболее приемлемым процессом, так как вирусные антигены экспрессируются на клеточной поверхности в сочетании с антигенами гистосовместимости хозяина, обеспечивая, тем самым, наряду с гуморальным иммунным ответом, и эффективный клеточный ответ [1131]. Основной недостаток таких клеточных систем — потенциально существующая опасность их возможной онкогенности. По мнению авторитетных специалистов, клиническая оценка безопасности антигенов, полученных при использовании клеточных линий и рекомбинантных векторов, содержащих фрагменты трансформирующих вирусов, является условной [1131, 1167]. Однако существующие методы очистки антигенов от клеточной и вирусной ДНК, а также других продуктов метаболизма, дают возможность получить препараты, отвечающие существующим требованиям, и практически снимают ограничения с использования постоянных линий клеток. Для экспрессии чужеродных вирусных белков широко используют перевиваемые линии клеток насекомых под контролем бакуловируса в качестве вектора. Таким путем были экспрессированы НА вируса гриппа, протективный антиген вируса гепатита Е, а так же белки других вирусов. Клетки млекопитающих широко используют для получения протективных вирусных белков, которые пригодны для приготовления субъединичных вакцин. Этот способ может быть использован для приготовления вакцин, когда вирус не размножается в культуре клеток (вирус гепатита В, парвовирус В19, вирус Норволк), или в случае, когда изготовление цельновирионной инактивированной вакцины представляет биологическую опасность (некоторые лентивирусы, филовирусы, хантавирусы и аренавирусы человека). Для крупных вирусов, таких как вирусы герпеса, которые кодируют около 10 протективных антигенов, может оказаться необходимым использовать для вакцины смесь нескольких экспрессированных белков [326].
www.med24info.com
"...Рекомбинантные вакцины - получают при клонировании генов, обеспечивающих синтез необходимых антигенов, введении этих генов в вектор, введении векторов в клетки-продуценты (вирусы, бактерии, грибы и пр.)..."
Источник:
"ПОРЯДОК УНИЧТОЖЕНИЯ НЕПРИГОДНЫХ К ИСПОЛЬЗОВАНИЮ ВАКЦИН И АНАТОКСИНОВ. МЕТОДИЧЕСКИЕ УКАЗАНИЯ. МУ 3.3.2.1761-03"
(утв. Главным государственным санитарным врачом РФ 05.10.2003)
Официальная терминология. Академик.ру. 2012.
рекомбинантные вакцины — Производятся при помощи рекомбинантной (генно инженерные) технологии. [Англо русский глоссарий основных терминов по вакцинологии и иммунизации. Всемирная организация здравоохранения, 2009 г.] Тематики вакцинология, иммунизация EN recombinant… … Справочник технического переводчика
Вакцина — У этого термина существуют и другие значения, см. Вакцина (значения). Вакцина (от лат. vacca корова) медицинский или ветеринарный препарат, предназначенный для создания иммунитета к инфекционным болезням. Вакцина изготавливается… … Википедия
Вакци́ны — (лат. vaccinus коровий) препараты, получаемые из микроорганизмов или продуктов их жизнедеятельности; применяются для активной иммунизации людей и животных с профилактической и лечебной целями. Вакцины состоят из действующего начала специфического … Медицинская энциклопедия
Биологические препараты — Биологические препараты группа медицинских продуктов биологического происхождения, в том числе вакцины, препараты крови, аллергены, соматические клетки, ткани, рекомбинантные белки. В состав биологических препаратов могут входить сахара,… … Википедия
Словарь генетических терминов — # А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ы … Википедия
Список генетических терминов — Эта страница глоссарий. См. также: Список генетических пороков развития и заболеваний Термины генетики в алфавитном поряд … Википедия
вирус — Термин вирус Термин на английском virus Синонимы Аббревиатуры Связанные термины бактериофаг, капсид Определение (лат. virus – яд) – автономные генетические структуры, не имеющие собственного метаболизма и способные размножаться только в… … Энциклопедический словарь нанотехнологий
Интерферон — Интерфероны общее название, под которым в настоящее время объединяют ряд белков со сходными свойствами, выделяемых клетками организма в ответ на вторжение вируса. Благодаря интерферонам клетки становятся невосприимчивыми по отношению к… … Википедия
Чума мелких жвачных — Чума мелких жвачных высококонтагиозная вирусная болезнь овец и коз, протекающая преимущественно остро или подостро, характеризующаяся лихорадкой, язвенными поражениями слизистых оболочек ротовой и носовой полостей, конъюнктивитами,… … Википедия
Биотехнологии — совокупность технологий, использующих характерные для живой природы способы преобразования вещества и получения разнообразных полезных эффектов. Среди этих технологий можно выделить биоинженерию (генную инженерию), биологический синтез… … Толковый словарь «Инновационная деятельность». Термины инновационного менеджмента и смежных областей
official.academic.ru
Содержат компоненты клеточной стенки или других частей возбудителя, как например в ацеллюлярной вакцине против коклюша, коньюгированной вакцине против гемофильной инфекции или в вакцине против менингококковой инфекции.
Химические вакцины- создаются из антигенных компонентов, извлеченных из микробной клетки. Выделяют те антигены, которые определяют иммуногенные характеристики микроорганизма. К таким вакцинам относятся: полисахаридные вакцины (Менинго А+С, Акт-ХИБ, Пневмо 23, Тифим Ви), ацеллюлярные коклюшные вакцины.
В 80-е годы зародилось новое направление, которое сегодня успешно развивается, - это разработка биосинтетических вакцин - вакцин будущего. Биосинтетические вакцины - это вакцины, полученные методами генной инженерии и представляют собой искусственно созданные антигенные детерминанты микроорганизмов. Примером может служить рекомбинантная вакцина против вирусного гепатита B, вакцина против ротавирусной инфекции. Для их получения используют дрожжевые клетки в культуре, в которые встраивают вырезанный ген, кодирующий выработку необходимого для получения вакцины протеин, который затем выделяется в чистом виде. На современном этапе развития иммунологии как фундаментальной медико-биологической науки стала очевидной необходимость создания принципиально новых подходов к конструированию вакцин на основе знаний об антигенной структуре патогена и об иммунном ответе организма на патоген и его компоненты.
Биосинтетические вакцины представляют собой синтезированные из аминокислот пептидные фрагменты, которые соответствуют аминокислотной последовательности тем структурам вирусного (бактериального) белка, которые распознаются иммунной системой и вызывают иммунный ответ. Важным преимуществом синтетических вакцин по сравнению с традиционными является то, что они не содержат бактерий и вирусов, продуктов их жизнедеятельности и вызывают иммунный ответ узкой специфичности. Кроме того, исключаются трудности выращивания вирусов, хранения и возможности репликации в организме вакцинируемого в случае использования живых вакцин. При создании данного типа вакцин можно присоединять к носителю несколько разных пептидов, выбирать наиболее иммуногенные из них для коплексирования с носителем. Вместе с тем, синтетические вакцины менее эффективны, по сравнению с традиционными, т.к. многие участки вирусов проявляют вариабельность в плане иммуногенности и дают меньшую иммуногенность, нежели нативный вирус. Однако, использование одного или двух иммуногенных белков вместо целого возбудителя обеспечивает формирование иммунитета при значительном снижении реактогенности вакцины и ее побочного действия.
Вакцины, полученные методами генной инженерии. Суть метода: гены вирулентного микроорганизма, отвечающий за синтез протективных антигенов, встраивают в геном какого - либо безвредного микроорганизма, который при культивировании продуцирует и накапливает соответствующий антиген. Примером может служить рекомбинантная вакцина против вирусного гепатита B, вакцина против ротавирусной инфекции. Наконец, имеются положительные результаты использования т.н. векторных вакцин, когда на носитель - живой рекомбинантный вирус осповакцины (вектор) наносятся поверхностные белки двух вирусов: гликопротеин D вируса простого герпеса и гемагглютинин вируса гриппа А. Происходит неограниченная репликация вектора и развивается адекватный иммунный ответ против вирусной инфекции обоих типов. Действие отдельных компонентов микробных, вирусных и паразитарных антигенов проявляется на разных уровнях и в разных звеньях иммунной системы. Их результирующая может быть лишь одна: клинические признаки заболевания - выздоровление - ремиссия - рецидив - обострение или другие состояния организма. Так, в частности, АДС - через 3 недели после ее введения детям приводит к возрастанию уровня Т-клеток и увеличению содержания ЕКК в периферической крови, поливалентная бактериальная вакцинаLantigen B стимулирует антителообразование Ig A в крови и слюне, но самое главное, что при дальнейшем наблюдении у вакцинированных отмечено уменьшение числа случаев заболевания, а если они и возникали, то протекали легче. Клиническая артина болезни, т.о. является наиболее объективным показателем вакцинации. Рекомбинантные вакцины - для производства этих вакцин применяют рекомбинантную технологию, встраивая генетический материал микроорганизма в дрожжевые клетки, продуцирующие антиген. После культивирования дрожжей из них выделяют нужный антиген, очищают и готовят вакцину. Примером таких вакцин может служить вакцина против гепатита В (Эувакс В).
studfiles.net
Сконструирован химерный вирус, содержащий гены вакцинного штамма SA-14-14-2 вируса японского энцефалита и гены инфекционного клона 17D вируса желтой лихорадки. Химерный вирус размножался с высоким титром в культуре клеток, был авирулентным при интрацеребральном введении мышам и обладал выраженной иммуногенностью. Авирулентный фенотип химерного вируса сохранялся после 6 пассажей в головном мозге мышей [745а]. Рекомбинантный вирус оспы птиц, экспрессирующий ген гликопротеина В вируса болезни Марека оказался безопасным и защищал цыплят от заболевания [1230]. На основе вируса оспы птиц получена рекомбинантная вакцина против геморрагического энтерита индеек (аденовирус птиц тип 2), экспрессирущая белок гексонов [449]. Рекомбинантная вакцина по антигенности и иммуногеннос- ти не уступала коммерческой традиционной вакцине, но в отличие от нее не вызывала иммуносупрессии [745а]. Рекомбинанты вируса осповакцины, экспрессирующие гликопротеины В, D, Е, G, I вируса простого герпеса испытывали на мышах для сравнения имму- ногенности индивидуальных гликопротеинов. Гликопротеины D и В индуцировали выраженный синтез антител и повышали уровень элиминации вируса, а также защищали от развития латентного носительства ВПГ-1 в чувствительных ганглиях. Гликопротеин Е был слабым индуктором нейтрализующих АТ, а глико- протены G, Н и I вовсе не вызывали образования нейтрализующих АТ и не предотвращали латентное инфицирование ганглиев [353]. Варианты рекомбинантной вакцины против японского энцефалита созданы на основе вируса осповакцины. Они обеспечивали синтез гликозилированного неструктурного белка NS-1 и гликозилированного белка Е оболочки вириона. Рекомбинанты, экспрессирующие тот и другой вирусные белки, обладали высокой иммуногенностью. Две инъекции вакцины защищали мышей от 104ЛД50 вируса японского энцефалита. Высокий уровень защиты коррелировал с высоким уровнем АТ, обладающих нейтрализующей активностью и активностью в РТГА [1019]. Рекомбинанты вируса осповакцины, содержащие в геноме различные сочетания генов С, М, Е, NS-1 вируса клещевого энцефалита, размножали в культуре клеток CV-1. Двукратное введение мышам вируса, экспрессирующего белок Е оболочки вируса клещевого энцефалита, защищало их при контрольном заражении гомологичным вирулентным вирусом [15]. Гены структурных белков вируса классической чумы свиней были встроены в ген тимидинкиназы вируса осповакцины. В культуре клеток CV-1 рекомбинантный вирус экспрессировал все четыре структурных белка вируса чумы, которые по основным свойствам не отличались от соответствующих вирионных белков. Иммунизация рекомбинантным вирусом надежно защищала свиней от инфицирования вирулентным вирусом [1348]. Сконструирован рекомбинантный вирус осповакцины, экспрессирующий основной белок оболочки вируса лейкоза крупного рогатого скота. Иммунизация телят таким вирусом оказывала лишь частичный защитный эффект. Аналогичные результаты получены в других исследованиях при испытании рекомбинантного вируса на овцах.
Мыши, иммунизированные рекомбинантным вирусом осповакцины, кодирующим неструктурный белок NS-1 вируса денге, были полностью защищены от летального энцефалита при последующем заражении вирулентным вирусом [656]. В ген gill аттенуированного вакцинного штамма вируса инфекционного ринотрахеита крупного рогатого скота встроены последовательности кДНК, кодирующие мономерные и димерные формы эпитопов белка VP1 вируса ящура. Такая вакцина вызывала иммунитет к вирусу ринотрахеита и выработку антител против ящура [891]. Рекомбинантный бакуловирус экспрессировал капсидный белок VP 2 вируса катаральной лихорадки овец в иммуногенной форме. Добавление структурного белка VP5 усиливало иммуногенный эффект [1345]. С целью создания эффективной, безопасной и экономичной антирабичес- кой вакцины для профилактической иммунизации людей и животных получен рекомбинантный аденовирус серотипа-5 человека, содержащий ген гликопротеина вируса бешенства. Иммунизированные им мыши были защищены от летальной интрацеребральной инфекции [1272]. Получен рекомбинантный вирус осповакцины, содержащий одновременно участки генома вирусов гепатита В, гриппа и герпеса простого, который экспрессировал HBsAg вируса гепатита В, гемагглютинин — вируса гриппа и гликопротеин D вируса герпеса простого [41]. Таким образом, в качестве векторов для создания рекомбинантных вакцин используют различные стабильные аттенуированные вирусы. Наибольший успех был достигнут при использовании вируса осповакцины в качестве рекомбинантного вектора. Такой рекомбинантный вирус мог экспрессировать протективные антигены большого количества вирусов, в том числе его использовали для иммунизации против бешенства. Вставка гена гликопротеина вируса бешенства в ген тимидинкиназы вируса вакцины приводит к снижению его вирулентности. В силу того, что геном вируса осповакцины способен включать много чужеродных генов без потери способности формировать вирионную структуру, теоретически возможно конструировать в качестве вектора один рекомбинантный вирус, способный защищать против нескольких вирусных болезней. Использование вируса оспы птиц в качестве вектора при создании рекомбинантных вакцин для птиц представлялось весьма логичным. Однако большим сюрпризом оказалось то, что вирус оспы птиц может служить вектором при имм- мунизации млекопитающих. Допускается возможность, что этот вирус и тесно связанный с ним вирус оспы канареек, также используемый в качестве вектора, не реплицируются с образованием инфекционного вируса в клетках млекопитающих, но включенные в их геном чужеродные гены экспрессируются и вызывают специфический иммунный ответ. Возможно, что такие векторы вызывают абортивную инфекцию in vivo с экспрессией чужеродных антигенов, вызывая клеточный и гуморальный иммунитет. Такие нереплицирующие векторы являются безопасными для иммуносу- прессивных хозяев.
Необходимо иметь в виду, что введение рекомбинантных живых вакцин в организм может вызывать иммунный ответ как против вируса донора чужеродного гена, так и против векторного вируса. Однако непохоже, чтобы рекомбинантные субъединичные вакцины были эффективнее рекомбинантных векторных вакцин, ограниченных однократным применением из-за развития иммунитета к векторному вирусу. Отдельные векторные вакцины применяют в полевых условиях. Это вакцина против бешенства лис, применяемая для профилактики бешенства в Европе, и вакцина против бешенства хорьков, применяемая в США. Вакцина против чумы КРС (основанная на вирусе осповакцины и вирусе оспы коз) применяется в Африке. Недавние исследования подтвердили, что адено-, герпес- и парвовирусы могут также служить векторами и могут иметь преимущества в экспресии генов гетерологичных вирусов.
www.med24info.com
3. Рекомбинантные вакцины и анатоксины
Пример такой вакцины – вакцина против вирусного гепатита В. При ее приготовлении встраивают субъединицу гена вируса в дрожжевые клетки. Затем дрожжи культивируются и из них выделяется НВsAg. Его очищают от дрожжевых включений. Этот способ приготовления вакцины называется рекомбинантным. Эта вакцина также содержит консервант и адсорбент в виде гидроокиси алюминия.
Анатоксины – это вещества, вырабатываемые возбудителями. При приготовлении ряда вакцин невозможно использовать сам возбудитель, поэтому в этих случаях берется их токсин. Это столбнячный, дифтерийный, стафилококковый и некоторые другие токсины.
Анатоксины вызывают стойкий антитоксический иммунитет, их легко комбинировать и дозировать. Их получают путем обработки токсина формальдегидом в особых температурных условиях. При этом токсин обезвреживается, но его иммунные свойства сохраняются. Вырабатываемый анатоксинами иммунитет только антитоксический. При применении анатоксинов возможно бактерионосительство и возникновение легких форм заболевания.
Поделитесь на страничкеСледующая глава >
med.wikireading.ru